สภาพความเป็นด่าง (Alkalinity)
♦ หน่วยที่นิยมใช้แสดงค่าความเป็นด่าง คือ มก./ลิตร ของ CaCO3
(แคลเซียมคาร์บอเนต หรือ หินปูน)
ความกระด้าง (Hardness)
♦ ความกระด้างของน้ำเป็นการวัดค่าความเข้มข้นของ แคลเซียม แมกนีเซียม เหล็ก
แมงกานีส ส่วนโลหะชนิดอื่นพบได้น้อยมากจึงไม่นิยมมาพิจารณา
♦ น้ำที่มีความกระด้างเกิดจากโลหะที่มีไอออน +2 (โดยทั่วไปอยู่ในรูปของเกลือไบคาร์บอเนต)
♦ น้ำที่มีความกระด้างจะทำให้เกิดปัญหาดังนี้ :
* เกิดตะกรัน
* เกิดตะกอนแข็งติดที่ผิววัสดุ
* เกิดสีเหลืองติดบนผ้า
* ทำให้การซักฟอกไม่มีฟอง เป็นต้น
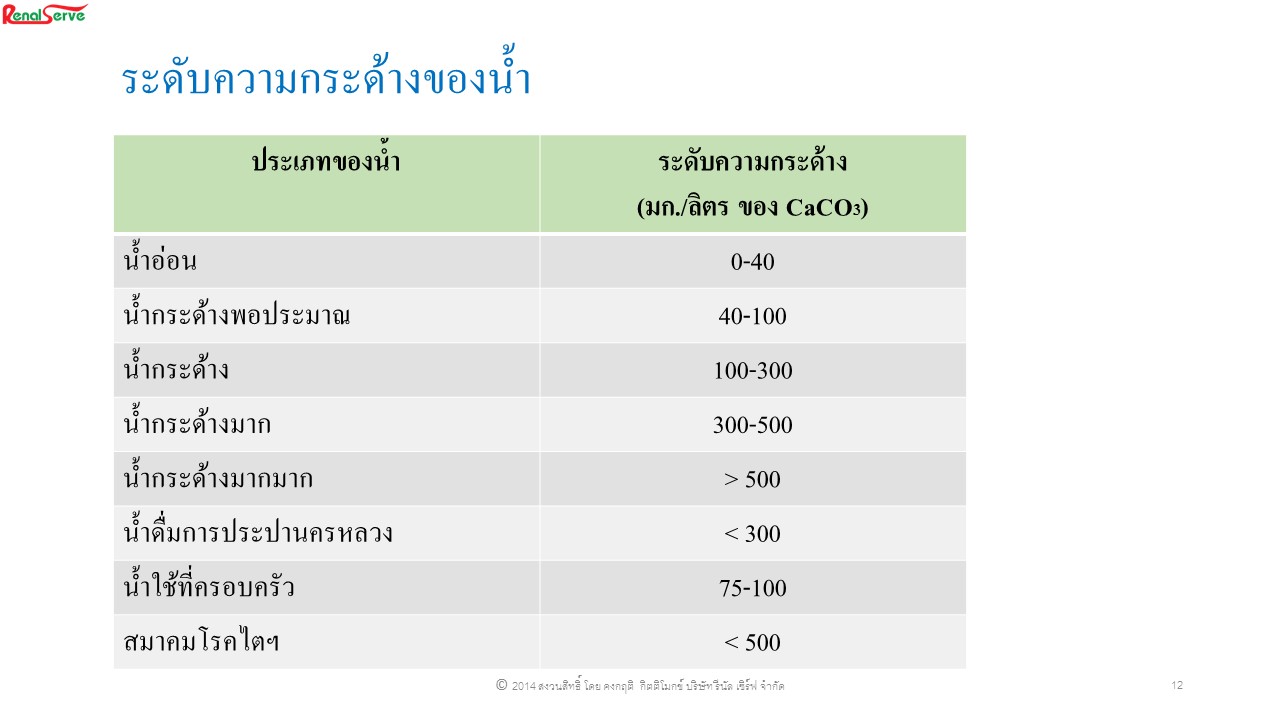
ความกระด้างของน้ำแบ่งได้ 2 ชนิด ขึ้นอยู่กับไอออนลบที่จับตัวกับ แคลเซียม และแมกนีเซียม
1. ความกระด้างชั่วคราว หรือความกระด้างคาร์บอเนต
(Temporary Hardness or Carbonate Hardness) Mg++, Ca++ รวมกับไอออนลบ
ที่เป็นพวก Alkalinity คือ HCO3¯(ไบคาร์บอเนต), CO3¯²(คาร์บอเนต), OH¯(ไฮดรอกไซด์)
กำจัดออกด้วยวิธี
♦ ต้มเพื่อให้เกิดการตกตะกอน (ใช้ได้เฉพาะน้ำที่มีแคลเซียม)
Ca(HCO3)2 แคลเซียมไบคาร์บอเนต + ความร้อน »»CaCO3 (ตะกอน)– CO2 + H2O
♦ ถ้าเกิดตะกรันให้แช่ด้วยกรดทั่วไป ถ้าล้างออกหมายถึง ตะกรันเกิดจากน้ำกระด้างชั่วคราว
♦ เติมปูนขาว และ/หรือ คาร์บอนไดออกไซด์
2. ความกระด้างถาวร หรือความกระด้างไม่มีคาร์บอเนต
(Permanent Hardness or Noncarbonate Hardness) Mg++, Ca++ รวมกับไอออนลบ
ที่เป็นพวก SO4¯²(ซัลเฟต), Cl¯(คลอไรด์), NO3¯(ไนเตรต)
กำจัดออกด้วยวิธี
♦ เติมโซเดียมคาร์บอเนต หรือเรียกว่า Soda Ash และปูนขาว ถ้าน้ำมีแมกนีเซียมปนอยู่ด้วย
อาจต้องเติมคาร์บอนไดออกไซด์เพิ่ม
♦ Ion Exchange ที่ใช้พวก Silicate เรียกว่าเครื่อง Zeolite Exchanger เพื่อกำจัด
ไอออนบวกของ Ca++, Mg++ …..
หมายเหตุ
น้ำที่มีน้ำทะเล หรือน้ำกร่อยแทรกเข้ามาทำให้มีปริมาณโซเดียมมากเกินปกติ(เกิดฟองสบู่ยาก)
คล้ายกับน้ำมีความกระด้างมากซึ่งความเป็นจริงอาจมีความกระด้างต่ำ ปรากฎการณ์นี้เรียกว่า
ความกระด้างเทียม (Pseudo Hardness)
* โซเดียมไม่ทำให้เกิดความกระด้างเพราะโซเดียมมีไอออนบวกเดียว (+) เท่านั้น





![images[5].png](/images/header/crop-1443440347658.png)
![images[8].jpg](/images/header/crop-1443434502091.jpg)

![images[2].jpg](/images/header/crop-1443435028652.jpg)
